Исследователи из Колумбийского университета создали новый способ использования света для воздействия на собственные белки животных с целью управления складыванием в живых эмбрионах.
Ученые с помощью света управляют развитием тканей эмбриона
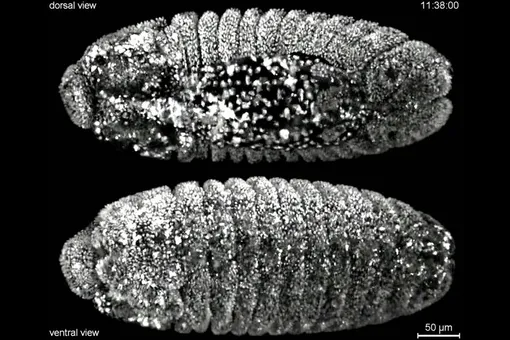
Результаты исследования, опубликованные в журнале Nature Communications, могут найти широкое применение в биоробототехнике и медицинских исследованиях. «Возможность точно контролировать форму складок в тканевых слоях является основополагающим шагом к "тканевому оригами", которое можно использовать для изучения трехмерной биологии тканей вне развивающихся эмбрионов или для создания и управления движением крошечных машин или роботов из живых биологических клеток», — отметила Карен Каша, старший автор исследования.
Тканевое оригами
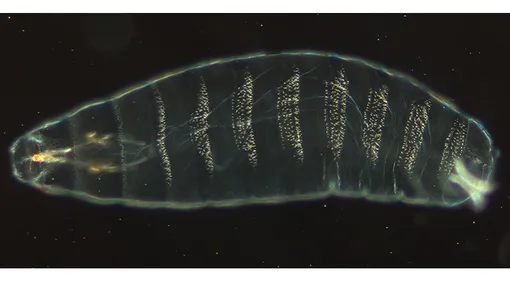
Основным механизмом формирования органов в развивающихся эмбрионах является образование борозд — углублений в тканях, которые впоследствии становятся местами складок. Подобно тому, как плоский лист бумаги можно сложить в журавлика, плоская эмбриональная ткань может быть сложена в предшественника органа.
В новом исследовании ученые экспериментировали с плодовой мушкой дрозофилой. Они модифицировали белки, которые клетки используют для создания механических сил. Ученые сделали эти молекулы чувствительными к свету. Направляя световые паттерны определенных длин волн на генетически модифицированные эмбрионы мух, исследователи смогли контролировать паттерны сил во время их развития.
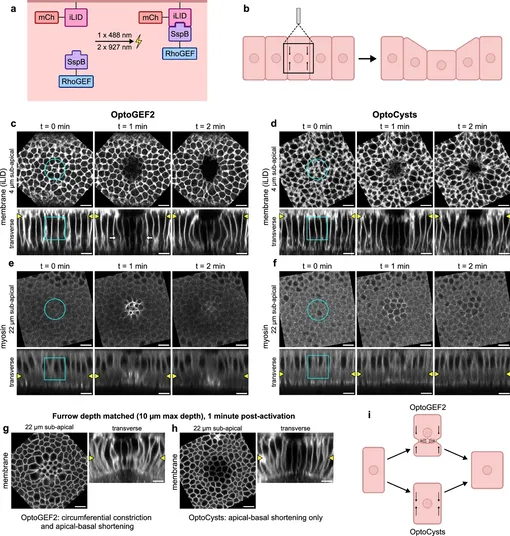
Исследование использовало систему редактирования генов CRISPR-Cas9 для добавления светочувствительного модуля к генам, естественно существующим у плодовых мушек. Полученные молекулы стали первыми инструментами, позволяющими ученым использовать свет для управления собственными генами животного с целью направления механических сил в живых эмбрионах.
Исследователи обнаружили, что глубина борозды зависит от количества белков, которые привлекаются к мембране клетки. Они также выяснили, что жесткие слои белков внутри эмбрионов могут кардинально влиять на способы образования борозд в тканях.
Методика может помочь ученым лучше анализировать развитие тканей и органов, используя свет для складывания базовых клеточных слоев в сложные трехмерные структуры в лабораторных условиях. В будущем исследователи планируют применить свою стратегию для изучения других способов образования борозд в тканях, а также других тканевых процессов.
