Fusobacterium nucleatum — анаэробная бактерия, которая в повышенных концентрациях обнаруживается в микробиоте кишечника пациентов с колоректальным раком. Эта бактерия способствует развитию опухолей, колонизируя раковые клетки и подавляя иммунные механизмы защиты организма. Понимание того, как именно бактерия прикрепляется к клеткам-мишеням, может предоставить ключевые цели для разработки новых противоопухолевых терапий.
Бактерии могут приклеиваться к раковым клеткам «на липучке», и эту связь можно атаковать
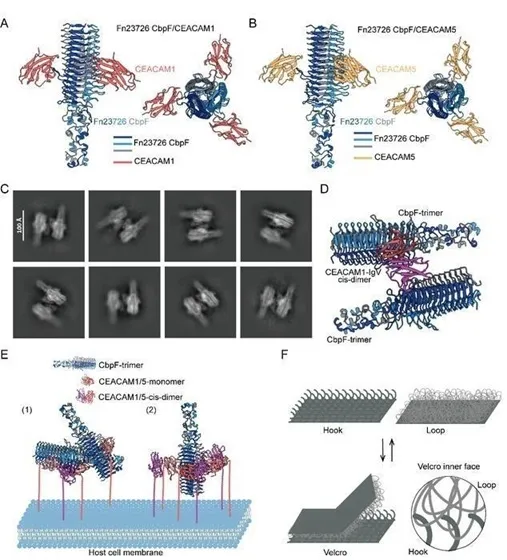
В ходе исследования ученые установили, что F. nucleatum использует свой белок CbpF для специфического связывания с рецепторами CEACAM1 и CEACAM5, которых очень много на поверхности различных типов раковых клеток. Причем CEACAM1 подавляет активность иммунных клеток при взаимодействии с бактерией.
С помощью криоэлектронной микроскопии исследователи получили структуры высокого разрешения комплексов CbpF с рецепторами CEACAM1 и CEACAM5. На основе полученных данных исследователи предложили модель бактериальной связи по принципу «липучки». Гибкий белок бактерии действует как «петля», взаимодействуя с рецептором клетки, как с «крючком». Такой механизм позволяет бактериям динамически регулировать силу прикрепления под механическим стрессом, и обеспечивает как прочное прикрепление, так и легкое отделение при необходимости адаптации к сложным физиологическим условиям. Работа опубликована в журнале PNAS.
Новые стратегии лечения
Теперь, понимая характер связывания бактерии с раковой клеткой, ученые планируют двигаться сразу в нескольких направлениях при разработке противораковой терапии. Одно из них — разрушение связи. Малые молекулы или антитела могут вмешиваться в интерфейс связывания. Это восстановит способность иммунной системы атаковать бактериальные колонии на опухолевых клеток.
Другим вариантом является возможность создания безвредных молекул, которые замкнут «крючки» раковых клеток на свои «петли», и заблокируют возможность присоединения бактерий к клеткам.
Возможно сочетание нескольких подходов: уменьшение количества бактерий специфическими антибиотиками, блокировка связей оставшихся бактерий с клетками, подавление раковых рецепторов и стимуляция иммунитета. Эта работа дает четкие молекулярные мишени для создания лекарств, что гораздо продуктивнее попыток «вслепую» воздействовать на весь процесс.