Протоковая аденокарцинома поджелудочной железы остается одним из наиболее летальных онкологических заболеваний: менее 10% пациентов переживают пятилетний рубеж после постановки диагноза. Опухоль окружена плотной фиброзной тканью, которая функционирует как защитная броня, затрудняя доставку лекарств. Именно эта плотная структура теоретически должна была бы ограничивать способность опухоли к распространению, но рак активно метастазирует — противоречие, которое долгие годы ставило исследователей в тупик.
Ученые разгадали тайну высокой смертности от рака поджелудочной железы

Результаты, опубликованные в журнале Molecular Cancer, показывают, что рецептор ALK7 запускает два взаимосвязанных биологических пути. Первый путь повышает вероятность проникновения раковых клеток через ткань, второй — производит ферменты, разрушающие стенки кровеносных сосудов.
«Другими словами, ALK7 дает раковым клеткам поджелудочной железы одновременно двигатель для движения и инструменты для вторжения», — объясняет соавтор исследования Эсак Ли, профессор биомедицинской инженерии.
Чем раньше удастся остановить метастазы, тем лучше для пациента
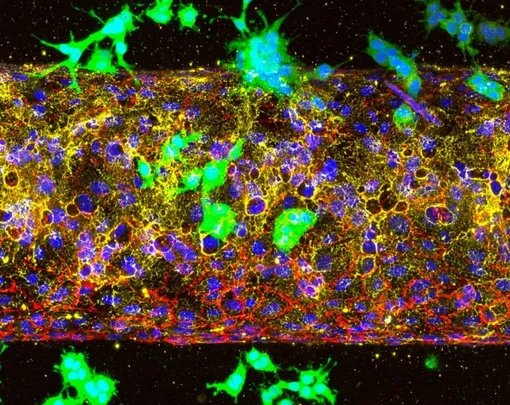
Используя модели на мышах и системы «орган-на-чипе», воспроизводящие человеческие кровеносные сосуды, команда продемонстрировала, что блокирование ALK7 значительно снижает способность рака распространять метастазы. Критически важным оказался момент вмешательства: когда развитие ALK7 останавливали на ранней стадии, раковые клетки не могли проникнуть в сосуды.
На более поздних этапах, когда клетки уже находились в кровотоке, они быстро распространялись. «Если мы упускаем эту раннюю возможность блокировать рецепторы ALK7, раковые клетки свободно циркулируют в кровотоке и легко образуют метастазы в других органах, — отмечает Ли. — Но если мы сможем остановить ALK7 на самой ранней и наиболее уязвимой стадии рака, результаты для пациентов будут значительно лучше».